La captación multilingüe de pacientes en ensayos clínicos se ha convertido en un requisito esencial para cumplir con las normativas FDA y EMA en 2025. Ya no basta con materiales en un solo idioma: los formularios de consentimiento informado, resúmenes en lenguaje sencillo y aplicaciones de eConsent deben estar disponibles en varios idiomas, ser accesibles y fáciles de comprender. Incorporar traducción médica profesional y accesibilidad digital desde la fase de diseño del protocolo no solo garantiza el cumplimiento regulatorio, sino que también acelera la inclusión de pacientes y refuerza la confianza en el estudio.
¿Por qué los ensayos ya no pueden permitirse una captación de pacientes en ensayos clínicos monolingüe?
La Ley de Reforma de Alimentos y Medicamentos de 2022 (FDORA) hizo que los Planes de Acción de Diversidad (DAPs) fueran jurídicamente vinculantes, y la guía preliminar de la FDA (que se finalizará a mediados de 2025) establece que cada plan debe explicar cómo se entregarán los materiales dirigidos a pacientes “en los idiomas relevantes para los objetivos de inclusión”. En la UE, el Reglamento 536/2014 ya obliga a los patrocinadores a publicar resúmenes en lenguaje sencillo en todos los idiomas de los participantes en un plazo de 12 meses tras el cierre de la base de datos.
Los modelos de ensayos descentralizados e híbridos aumentan el riesgo: cada recordatorio por SMS, chatbot o pantalla de eConsent debe permitir al paciente cambiar de idioma, redimensionar el texto o activar la función de texto a voz—o los patrocinadores se arriesgan a desviaciones del protocolo y consultas del comité de ética (IRB). Una encuesta del DIA Global Forum de marzo de 2025 incluye las “lagunas de idioma y accesibilidad” entre las 10 principales limitaciones operativas en los ensayos clínicos descentralizados (DCTs).
En resumen: la velocidad de captación de pacientes, el cumplimiento normativo y la confianza del paciente dependen ahora de acertar con el idioma, la legibilidad y la accesibilidad en el diseño del protocolo—no después de presentarlo al comité de ética.

¿Qué hay de nuevo en el conjunto normativo de 2025?
FDA EE. UU.
- Requisito clave 2025: El DAP debe incluir disposiciones de acceso lingüístico para grupos infrarrepresentados. Guía preliminar con finalización prevista para junio de 2025.
- Importancia: Los comités de ética pueden rechazar planes que omitan la localización, retrasando el first-patient-in (FPI).
UE/EMA
- Requisito clave 2025: Resúmenes en lenguaje sencillo en todos los idiomas de los participantes + objetivos de legibilidad (equivalente a cursos 6º–8º).
- Importancia: La redacción multilingüe en lenguaje sencillo pasa a ser objeto de auditoría trazable.
Accesibilidad
- Requisito clave 2025: Cumplimiento WCAG 2.2 AA y Sección 508 para todos los activos digitales de captación.
- Importancia: Las aplicaciones de eConsent o DCT sin subtítulos o texto alternativo pueden obligar a enmiendas del protocolo.
¿Dónde siguen fallando los patrocinadores en la captación multilingüe de pacientes?
- Solicitud tardía de localización
- Impacto: Añade 4–6 semanas por retrotraducción y nueva revisión del comité de ética.
- Ejemplo real: Se volvieron a presentar 12 versiones de un ICF (Formulario de Consentimiento Informado) después de que el comité de ética señalara sedes no anglófonas.
- Dependencia excesiva de traducción automática bruta (MT)
- Impacto: Provoca lagunas en glosarios, bloqueos de calidad y enmiendas necesarias.
- Ejemplo real: Un término sobre interacción farmacológica se tradujo mal en un centro piloto en hausa.
- Ignorar la accesibilidad
- Impacto: Un eConsent no conforme paraliza el despliegue.
- Ejemplo real: Un panel carecía de subtítulos y etiquetas para lectores de pantalla.
- Control de versiones fragmentado
- Impacto: Genera inconsistencias en el lenguaje de riesgos entre distintos canales de comunicación.
- Ejemplo real: Folletos, SMS y comunicaciones de chatbot incluían advertencias divergentes.
La lista de 2025 de DIA confirma que el idioma y la accesibilidad se encuentran entre los 10 principales cuellos de botella en los ensayos clínicos descentralizados (DCT).
Integrar idioma y accesibilidad en la cronología del protocolo
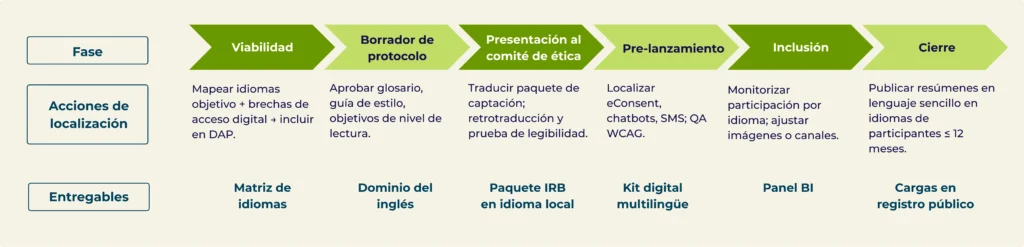
Mini caso — Oncología en Fase III: 12 países, 18 idiomas, FPI cinco semanas antes
El reto.
Un patrocinador global necesitaba reclutar a 900 pacientes infrarrepresentados en EE. UU., Brasil y la UE. Los reguladores exigían un Plan de Acción de Diversidad que mapease explícitamente materiales de captación y consentimiento en 18 idiomas, con redacción en lenguaje sencillo y activos digitales conformes a WCAG. Los plazos eran ajustados y el FPI estaba en riesgo.
Qué hicimos.
En la semana 0, nuestros redactores médicos reescribieron el paquete maestro en lenguaje sencillo (≈ nivel de lectura cursos 6º–8º) y establecieron un glosario y guía de estilo compartidos. En 48 horas produjimos una primera pasada con traducción automática neuronal con terminología bloqueada, luego realizamos validación clínica en país y retrotraducción con reconciliación para contenido de alto riesgo (ICF y alertas de seguridad). En paralelo, añadimos la capa de accesibilidad (PDF etiquetados, subtítulos/captions, texto alternativo ≤ 125 caracteres, texto a voz) y empaquetamos todo para la plataforma de eConsent en HTML adaptable + WebVTT. Un centro de control de versiones distribuyó cualquier “delta” del protocolo a todos los idiomas en ≤ 24 horas.
El resultado.
- Kit completo de captación en 18 idiomas entregado en 14 días (vs. 20 días de referencia histórica).
- ≈30% de reducción de tiempos gracias al modelo IA + humanos.
- Aprobación del comité de ética en primera presentación sin observaciones lingüísticas.
- FPI alcanzado cinco semanas antes de la fecha contractual.
Conclusiones clave.
Integrar la matriz de idiomas en el DAP desde el primer borrador, combinar la revisión clínica con la reescritura en lenguaje sencillo, tratar la accesibilidad como innegociable e integrarse con el stack DCT/eConsent antes del comité de ética—esas cuatro medidas protegen los plazos y los objetivos de diversidad.
Preguntas frecuentes (FAQ) sobre la captación multilingüe de pacientes
P1. ¿Cuántos idiomas necesitamos realmente?
Cubrir los principales idiomas de los pacientes en cada centro más cualquier grupo minoritario crítico para los objetivos de diversidad—ese es el criterio de la FDA para considerar un idioma “relevante” en un DAP. (Administración de Alimentos y Medicamentos, FDA, por sus siglas en inglés)
P2. ¿Aceptarán los comités de ética traducciones generadas por IA?
Sí—si se documenta posedición cualificada, revisión clínica, retrotraducción y control de versiones. La traducción automática bruta rara vez supera la revisión ética.
¿Quieres mejorar tus materiales de captación multilingüe de pacientes y cumplir con FDA/EMA sin retrasos?
¡Hagamos que cada paciente—en cada idioma—se sienta realmente bienvenido en su ensayo!
Solicita tu consulta gratuita de 15 minutos y transforma la captación multilingüe de pacientes en ensayos clínicos con traducción médica experta y servicios de accesibilidad.